一、信号检测与风险评估工作如何开展?
(一)明确信号来源:个例药品不良反应报告(包括临床试验/SUSAR、患者支持项目、上市后的自发报告等);发表的科学文献;定期安全性更新报告(PSUR/PBRER、DSUR);药品监督管理部门的要求;药品不良反应聚集性事件等。
(二)确定检测频率:根据药品的风险特征、药品上市时间、药品特点、工作模式、信号检测方法等确定信号检测频率。
(三)开展信号检测,筛选信号。信号检测方法可以是个例药品不良反应报告审阅、病例系列评价、病例报告汇总分析等人工检测方法,也可以是数据挖掘等计算机辅助检测方法。
1.人工信号检测
(1)个例报告审阅
①个例报告审阅是指对单个药品不良反应病例报告进行的审阅和评价。对于基于个例报告产生信号,药品-事件之间的关联性评价至关重要。有时,一例信息充分的个例报告即可被识别为一个潜在信号,也有人建议当这些类型的事件出现1~3例报告即可视为一个潜在的信号。报告审阅人员主要根据以下两种方法进行关联性评价:审阅含“特定医学事件”(DME)的报告,目前尚无权威的“特定医学事件”列表,可参考信息包括: WHO乌普萨拉监测中心的药品不良反应“关键术语”列表;美国FDA的“应关注的首选术语”列表;欧洲药品管理局的“特定医学事件”列表等。
②捕捉报告中的显著性信息
报告提供的显著临床信息可为评价人员“捕捉”信号提供线索,如:
患者使用药物后快速发生严重的不良事件;
去激发/再激发阳性;
有显著的剂量相关特征;
出现3例以上罕见不良反应,而该反应在正常人群中背景发生率很低;
特定医学事件等。
(2)病例系列评价
病例系列评价是指在一个相对短的周期内(例如月、季度),对一组相同或类似药品不良反应/事件病例报告的集合(即病例系列)开展描述和分析。
该方法不需要严格设计;更加贴近药物警戒工作实际;能准确而透明的反映不良反应/事件的具体情况。
病例系列评价基于个例报告审阅的基础之上,也没有病例报告汇总分析复杂全面。因此持有人应设计较为简单明确的病例系列评价方案,以便于经常性、常规化开展。
(3)病例报告汇总分析
个例报告或病例系列的评价可能发现一些罕见的、非预期的不良反应,但对于报告量相对较大的品种,或单个病例报告信息不足以支持评价的情况,尤其一些以聚集性为特征的安全信号,通过对病例报告的汇总分析来发现信号则更加可行。
持有人定期(如半年、每年)开展的汇总分析,或持有人根据相关法规的要求定期撰写PSUR/PBRER,这些对数据的汇总分析过程都可能发现信号。
结合简单统计分析方法可能有助于发现药品安全信号,如:
特定不良事件的绝对数量占总报告数量的比例高于预期值;
单位时间内(如一个月、一季度)某不良反应报告数量占销量的比值高于预期值;
死亡病例报告数量呈现异常增长等简单统计分析方法;
按照生产批号统计,某些批号的不良反应报告数量远高于其他批号;
……
2.计算机辅助信号检测
信号检测流程:数据收集——数据处理——算法挖掘——信号生产
(1)单种药品信号检测方法
比值失衡分析法(频数法和贝叶斯法)等
(2)联合用药信号检测方法
频数统计模型、贝叶斯统计模型、回归模型和关联规则模型等。
(3)聚集性信号检测方法
基于预警规则的方法、聚类分析法、不相称测定分析等。
(四)信号验证
信号验证参考信息:既往认知情况、判断关联强度、结合临床背景、其他信息来源。
最终得出验证结果:已验证信号(处理方式:该类信号此时被称为安全性信号,需要进一步分析评价并形成完整的信号评价文件。);未验证信号(该类信号不需要进一步分析评价,只需记录未通过验证的原因,不需要书写信号评价文件。)
(五)信号优先级顺序评价
1.(GVP59条)信号优先级判定可考虑以下因素:药品不良反应的严重性、严重程度、转归、可逆性及可预防性;患者暴露情况及药品不良反应的预期发生频率;高风险人群及不同用药模式人群中的患者暴露情况;中断治疗对患者的影响,以及其他治疗方案的可及性;预期可能采取的风险控制措施;适用于其他同类药品的信号。
2.指定医疗事件清单(DME):清单中包括62个PT信号,包括过敏性休克、失明、肝衰竭、胰腺炎、肺动脉高压和心室纤颤等项目。
3.还可参考美国卫生及公共服务部2017年11月27日发布的《常见不良事件评价标准(CTCAE)》(5.0版)
(六)信号评价。信号评价是信号管理过程的核心步骤。持有人应当综合汇总相关信息,对检测出的信号开展评价,综合判断信号是否已构成新的药品安全风险。
信号评价考虑因素:个例报告的关联性评价、合理的作用机制、流行病学相关信息、证据的强度、参与信号评价的人员等。
信号评价的思路:①信号产生原因;②查阅背景资料(药品适应证的背景、不良事件的背景、不良事件与药品的关系、其他相关资料);③单个病例(ICSRs)回顾描述;④查阅科学文献;⑤讨论、结论和行动:信号被否定(不良事件和药品间的关联性不能建立。)、不确定信号(目前的数据既不能肯定也不能完全排除关联性。)、信号被肯定(有充分的证据证明不良事件和药品间的关联性,即该不良事件是药品的不良反应。)
信号分析评价的过程和结论都记录在信号评价文件中,以下是参考模板,因信号检测相关指导文件未出台,持有人可根据自身情况结合参考模板撰写。
1.原因:解释触发此次信号评价的原因,例如,药品监管部门的要求,计算机辅助或者人工信号检测的发现,临床试验的发现等。
2.背景资料:从三个方面阐述:1)药品适应症的背景,药品的适应症是否会导致该不良事件。2)不良事件的背景:哪些原因可以导致该不良事件,危险因素有哪些。3)不良事件与药品的关系:是否是已知不良反应,是否是同类其他药品的不良反应,之前是否有过类似分析。
3.毒理学的相关发现:在药品毒理学研究中是否有与所分析的不良事件有关的发现。
4.临床前试验的情况:在动物试验中是否观察到类似或相关发现。
5.干预性临床试验:临床试验中是否有该不良事件的报告,发生率如何,和阳性对照组或安慰剂组的比较。
6.观察性临床研究(非干预性):在观察性临床研究中观察到的类似或相关安全性情况。
7.流行病学研究:流行病学研究中的相关发现。
8.个例药品不良反应报告回顾:在药物警戒数据库中检索上市后个例药品不良反应报告,进行汇总分析。
9.科学文献:已经发表的科学文献中是否有类似的报道。检索文献时,还需关注同类产品类似事件的相关文献。检索科学文献数据库也需要明确检索条件。对有重要安全性信息的文献,需要审阅者提供自己的评价。
10.讨论:针对以上收集并分析的数据,讨论有哪些有意义的发现。
11.结论和行动:经过评价,是否认为信号和药品的使用相关联,以及需要采取的行动。
12.参考文献:逐条列出参考或引用的科学文献。
(七)风险分级。持有人可根据自身产品特点选择科学合理的风险分级方法及工具,综合整体事件影响确定风险评估优先顺序。
方法:风险优先系数(RPN)、风险优先级法、风险矩阵法
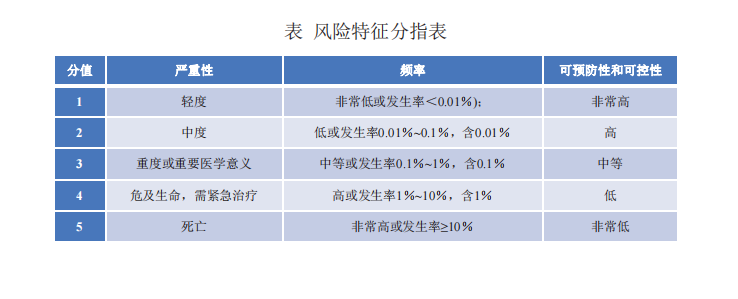
高度风险水平:初步风险评估结果风险优先系数(RPN)>25,或风险发生的严重性程度=5。
中等风险水平:10≤风险优先系数(RPN)≤25。
低风险水平:风险优先系数(RPN)<10。此风险危害性较低,可根据实际情况,确定是否采取必要的控制措施。
还应该结合其他风险特殊来综合判断!
风险评估工作流程
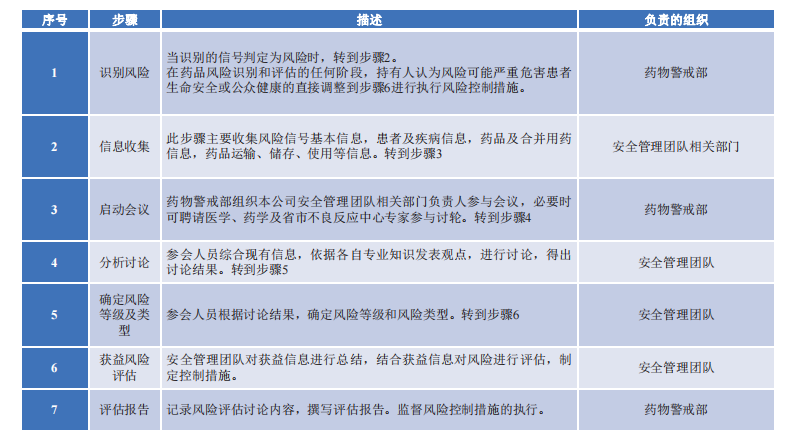
不确定的信号行动建议:持续监测;进一步收集信息;在PBRER/PSUR中定期回顾该信号。
被肯定的信号行动建议:
1.向药品监督管理部门快速报告新出现的严重的安全性问题或者确认的可能影响公众健康的信号;
2.快速报告临床试验中出现的安全性问题;
3.知会持有人管理层;
4.进一步收集信息;
5.在PBRER/PSUR中定期回顾该信号;
6.讨论是否需要更新说明书;
7.讨论是否需要更新说明书;
8.制定风险控制措施。
二.药物警戒计划如何撰写?
目前上市后“药物警戒计划”撰写模板及细则尚未发布。持有人在药品上市后形成“药物警戒计划”或“上市后风险管理计划”等风险管理相关文件时, 应充分参考上市申请获批时经药品审评中心确认的“临床风险管理计划”,并保持相关内容的一致性和可衔接性。详见《“临床风险管理计划”撰写指导原则(试行)》(2021年第68号)文件。
三.药品不良反应聚集性事件量化的判定条件?
目前新修订的《药品管理法》、《药物警戒质量管理规范》、《药品不良反应报告和监测管理办法》等法规文件均未量化药品不良反应聚集性事件的判定条件,建议持有人可参考《药品和医疗器械安全突发事件应急预案(试行)》中药品安全突发事件的分级标准。