药品安全 警戒护航 ——药物警戒法规历程回顾
2024年正值《药品管理法》颁布40周年。《药品管理法》中明确规定:国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制。
随着2019年修订的《药品管理法》的颁布实施,我国实施药物警戒制度上升至法律层面。国家药品监督管理局与国家药品不良反应监测中心近年发布了一系列药物警戒相关法规及指导原则,大力推动国内药物警戒事业的发展。构建完善的药物警戒制度,对于我国有效防控、应对和减轻药品风险具有至关重要的作用。
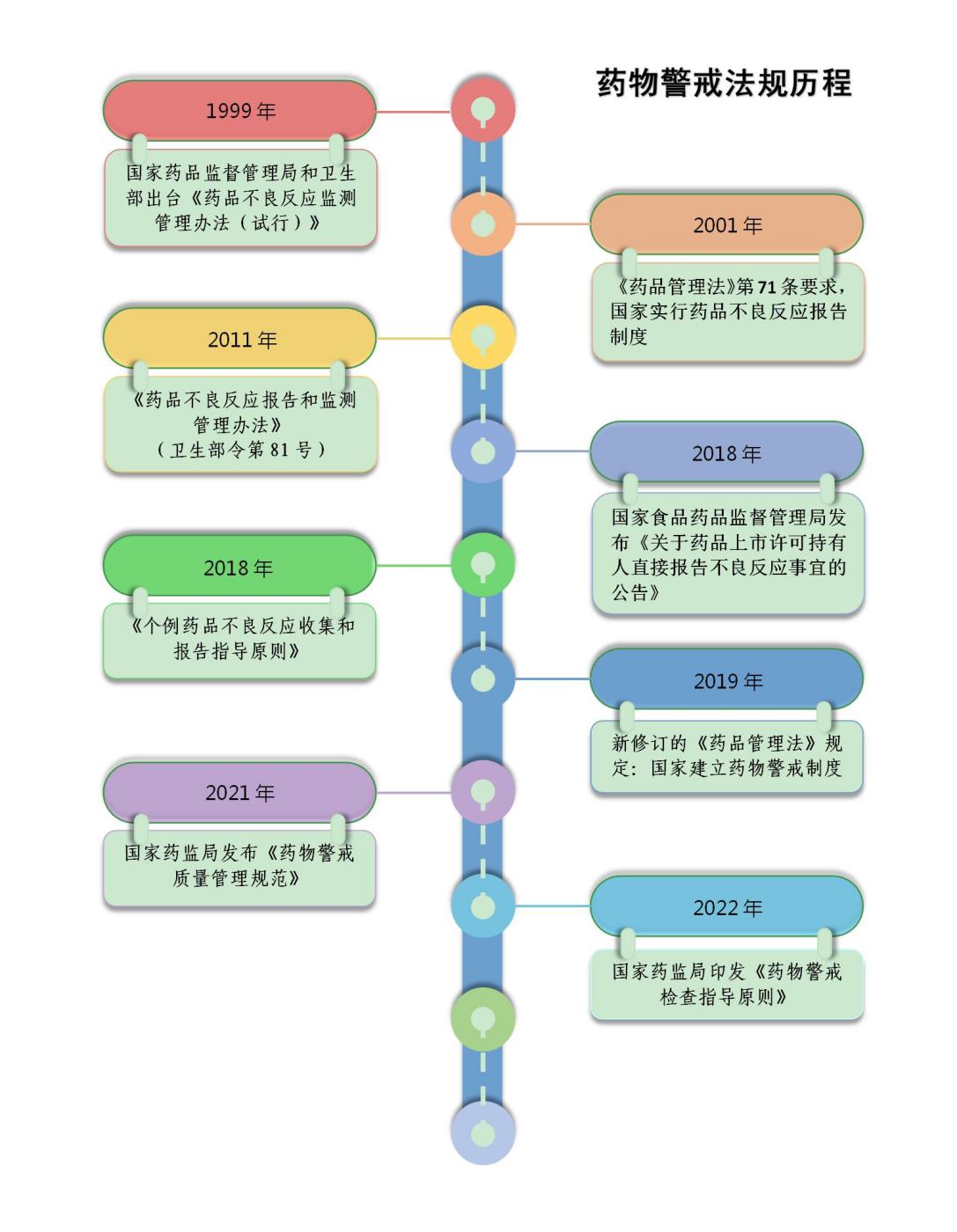
从时间轴上看,我国药物警戒制度的构建经历了从无到有,从粗放到精细的蜕变。自1999年建立药品不良反应监测机制以来,每一次法规的变化都是一次药物警戒工作的飞跃突破。展望未来,我国药物警戒制度还将不断完善,为人民群众用药安全提供更加坚实的保障。
什么是药品不良反应监测?
药品不良反应(英文Adverse Drug Reaction,缩写ADR),是指合格药品在正常用法用量下出现的与用药目的无关的有害反应。药品不良反应是药品固有特性所引起的,任何药品都有可能引起不良反应。
什么是药物警戒?
药物警戒(Pharmacovigilance,缩写PV)是指对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制的活动。
药物警戒是确保药品安全的重要环节。药物警戒工作离不开药品监管部门、药品上市许可持有人、医疗机构三方的共同努力。
药品监管部门建立健全药物警戒工作机制,推进药物警戒体系和能力建设,督促指导医疗机构和药品上市许可持有人持续完善药物警戒体系,防范药品安全风险。
药品上市许可持有人肩负药品安全主体责任,应主动建立和完善药物警戒质量管理体系,配备与自身规模相适应的药物警戒专职人员和资源,保障药物警戒活动的过程和结果符合法规要求,确保及时发现并控制药品安全风险。
医疗机构应持续提升药品不良反应/不良事件监测评价能力,及时、真实、规范、完整地报告疑似药品不良反应和采用有效措施控制临床用药风险,充分发挥警戒哨兵作用。
药品上市许可持有人、医疗机构、药品监管部门都应依法履行药物警戒责任,确保药品全生命周期的安全,降低药品安全风险,保护和促进公众健康。

